धातु एवं अधातु
धातु– वैसे तत्त्व जो विद्युतधनात्मक, आघातवर्धनीय, तन्य, उष्मा तथा विद्युत का सुचालक, चमकीला और कठोर होते हैं, उसे धातु कहते हैं। जैसे- सोडियम, मैग्नीशियम, जिंक, लेड, कॉपर, ताँबा, सोना, ऐलुमिनियम आदि।
अधातु– वैसे तत्त्व जो विद्युतधनात्मक, आघातवर्धनीय, तन्य, उष्मा तथा विद्युत का सुचालक, चमकीला और कठोर नहीं होते हैं, उसे अधातु कहते हैं। जैसे- कार्बन, सल्फर, आयोडिन, क्लोरिन, ऑक्सीजन, नाइट्रोजन आदि।
धातुओं के भौतिक गुण–
1. धातुएँ विद्युत धनात्मक होती है।
2. धातुएँ आघातवर्धनीय होती हैं।
3. धातुएँ तन्य होती हैं।
4. धातुओं के द्रवनांक एवं क्वथनांक उच्च होते हैं।
5. धातुएँ विद्युत और ऊष्मा की सुचालक होती है।
6. धातुओं में एक विशेष प्रकार की चमक होती है।
7. धातुएँ कठोर होती है।
8. धातुओं को हथौड़े से पीटने पर एक विशेष प्रकार की ध्वनि उत्पन्न होती है।
9. धातुएँ कमरे के ताप पर सामान्यतः ठोस होती है।
धातुओं के रासायनिक गुण–
1. सभी धातुएँ ऑक्सीजन के साथ संयोग करके ऑक्साइड बनाती है।
4Na + O2→ 2Na2O (सोडियम मोनोक्साइड)
2Mg + O2→ 2MgO (मैग्नीशियम मोनोक्साइड)
2. धातुएँ अम्लों के साथ अभिक्रिया करके प्रायः हाइड्रोजन गैस मुक्त करती है।
2Na + HCl → 2NaCl + H2↑
अधातुओं के भौतिक गुण–
1. अधातुएँ सामान्य ताप पर, ब्रोमीन को छोड़कर, ठोस एवं गैस के रूप में पाई जाती है।
2. अधातुएँ प्रायः भंगुर होती है।
3. अधातुओं में प्रायः कोई विशेष चमक नहीं होती है।
4. अधातुएँ ऊष्मा और विद्युत की कुचालक होती है।
5. अधातुएँ मुलायम होती है।
6. हथौड़े से पीटने पर अधातुओं में कोई ध्वनि नहीं निकलती है।
7. हाइड्रोजन को छोड़कर सभी धातुएँ विद्युत ऋणात्मक होती है।
अधातुओं के रासायनिक गुण–
1. अधातुएँ ऑक्सीजन के साथ संयोग करके अम्लीय ऑक्साइड बनाती है।
C + O2 → CO2
S + O2 → SO2
2. अधातुएँ जल के साथ अभिक्रिया नहीं करती हैं।
भौतिक गुणों के आधार पर धातु और अधातु में अंतर–
1. धातुओं में एक विशेष प्रकार की चमक होती है जबकि अधातुओं में ऐसी कोई चमक नहीं होती है। अपवाद- आयोडिन और ग्रैफाइट में धातुई चमक होती है।
2. धातुएँ प्रायः विद्युत धनात्मक होती है जबकि अधातुएँ प्रायः विद्युत ऋणात्मक होती है। सिर्फ हाइड्रोजन विद्युत धनात्मक होता है।
3. धातुएँ प्रायः ऊष्मा एवं विद्युत की सुचालक होती है जबकि अधातुएँ प्रायः ऊष्मा एवं विद्युत की कुचालक होती है। सिर्फ हाइड्रोजन एवं ग्रैफाइट विद्युत की सुचालक होती है।
4. साधारण ताप पर धातुएँ प्रायः ठोस होती है। सिर्फ मरकरी (पारा) ही ऐसी धातु है जो साधारण ताप पर द्रव होती है। जबकि अधातुएँ साधारण ताप पर ठोस या गैस होती है।सिर्फ ब्रोमीन साधारण ताप पर द्रव होती है।
5. धातुएँ आघातवर्धनीय तथा तन्य होती है जबकि अधातुएँ आघातवर्धनीय तथा तन्य नहीं होती हैं। अपवाद- प्लास्टिक गंधक तन्य होता है।
6. धातुओं के घनत्व उच्च होते हैं जबकि अधातुओं के घनत्व निम्न होते हैं।
7. हथौड़े से पीटने पर धातुओं से एक विशेष प्रकार की ध्वनि निकलती है जबकि अधातुओं को हथौड़े से पीटने पर टूट कर चूर हो जाती हैं।
रासायनिक गुणों के आधार पर धातु और अधातु में अंतर–
1. धातुओं के परमाणु धनायन बनाते हैं, जैसे- K+ , Na+, Ca2+ आदि। जबकि अधातुओं के परमाणु ऋणायन बनाते हैं। जैसे- Cl– , Br– , S2- आदि।
2. धातुओं के ऑक्साइड भास्मिक होते हैं
CaO + H2O → Ca (OH) 2
जबकि अधातुओं के ऑक्साइड अम्लीय होते हैं। ये जल से अभिक्रिया करके अम्ल बनाते हैं।
CO2 + H2O→ H2CO3
रासायनिक बंधन– वह रासायनिक बल जो किसी अणु में परमाणुओं को एकसाथ बाँधकर रखता है, रासायनिक बंधन कहलाता है।
रासायनिक बंधन के प्रकार–
1. वैद्युत संयोजक बंधन या आयनिक बंधन
2. सहसंयोजक बंधन
1. वैद्युत संयोजक बंधन या आयनिक बंधन–दो परमाणुओं के बीच एक परमाणु से दूसरे परमाणु में एक या अधिक इलेक्ट्रॉनों के स्थानांतरण के फलस्वरूप बने रासायनिक बंधन को वैद्युत संयोजक बंधन या आयनिक बंधन कहते हैं। इसक ध्रुवीय बंधन भी कहते हैं।
जैसे- सोडियम क्लोराइड का बनना
Na+ + Cl–→ Na+Cl–
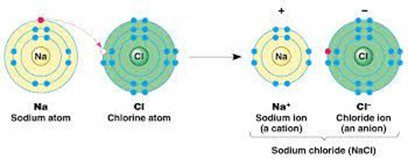
वैद्युत संयोजकता– किसी तत्त्व के परमाणु के आयन में परिवर्तित होने के लिए त्यक्त या प्राप्त इलेक्ट्रॉनों की संख्या उस तत्त्व की वैद्युत संयोजकता कहलाती है। जैसे- सोडियम क्लोराइड के बनने में सोडियम परमाणु एक इलेक्ट्रॉन का त्याग और क्लोरिन का परमाणु एक इलेक्ट्रॉन प्राप्त करता हैं। अतः सोडियम की वैद्युत संयोजकता +1 और क्लोरीन की वैद्युत संयोजकता -1 होती है। इसी प्रकार Mg, Ca और Be की संयोजकता +2 होती है।
सहसंयोजक बंधन–जब दो परमाणु आपस में इलेक्ट्रॉनों का साझा करके अपना अष्टक पूरा करते हैं तब उनके बीच बना हुआ रासायनिक बंधन सहसंयोजक बंधन कहलाता है।
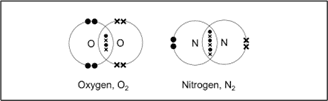
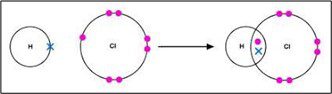
सहसंयोजक बंधन तीन प्रकार के होते हैं।
1. एकल सहसंयोजक बंधन
2. द्विक सहसंयोजक बंधन
3. त्रिक सहसंयोजक बंधन
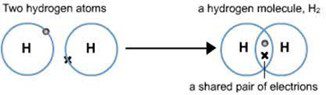
एकल सहसंयोजक बंधन–जब दो परमाणुओं के बीच इलेक्ट्रॉनों के सिर्फ एक युग्म साझा होता है तब उनके बीच बने बंधन को एकल सहसंयोजक बंधन कहते हैं।
हाइड्रोजन अणु का बनना
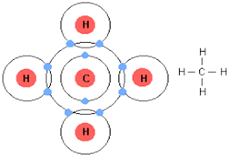
मेथेन अणु का बनना
द्विक सहसंयोजक बंधन–जब संयोग करने वाले दोनों परमाणु दो-दो इलेक्ट्रॉनों का साझा करते हैं तब उनके बीच बने बंधन को द्विक सहसंयोजक बंधन कहते हैं।
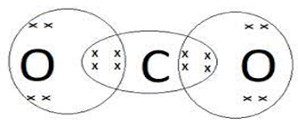
कार्बन डाइऑक्साइड का बनना–
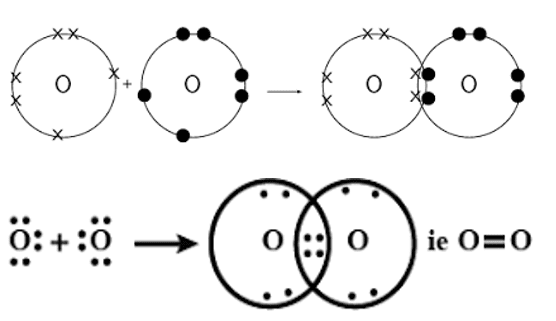
ऑक्सीजन का बनना–
त्रिक सहसंयोजक बंधन या त्रिबंधन– जब संयोग करनेवाले दो परमाणु तीन-तीन इलेक्ट्रॉनों का साझा करते है तब उन परमाणुओं के बीच बने बंधन को त्रिक सहसंयोजक बंधन कहते हैं।
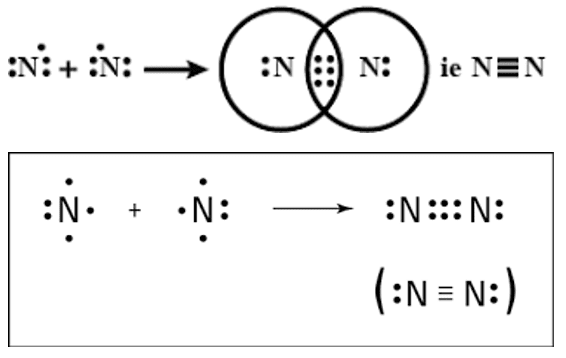
खनिज– पृथ्वी की परत में विद्यमान धातुयुक्त ठोस पदार्थ (तत्त्व या यौगिक) खनिज कहलाते हैं।
जैसे- प्रकृति में पाए जानेवाले सोडियम क्लोराइड(NaCl), कैल्सियम कार्बोनेट (CaCO3) आदि खनिज है।
अयस्क– जिस खनिज में प्रचुर मात्रा में धातु विद्यमान हो तथा जिससे कम खर्च में ही एवं सरलता से धातु प्राप्त की जा सके, उसे अयस्क कहते हैं।
जैसे- बॉक्साइड (Al2O3 . 2H2O) और मिट्टी (Al2O3 . 2SiO2 . 2H2O) दोनों ऐल्युमिनियम के खनिज हैं।
धातुकर्म– अयस्कों से धातुओं के निष्कर्षण एवं उनके शोधन की प्रक्रिया धातुकर्म कहलाती है।
गैंग– अयस्कों में उपस्थित अवांछनीय पदार्थ जैसे बालू, कंकड़ या मिट्टी के टुकड़े आदि को गैंग कहते हैं।
अयस्क का सान्द्रण– अयस्क में विद्यमान अपद्रव्यों को दूर करना अयस्क का सांद्रण कहलाता है।
निस्तापन– अयस्क को उच्च ताप पर वायु की अनुपस्थिति या अपर्याप्त आपूर्ति में उसके द्रवणांक से कम ताप पर धातु को ऑक्साइड में परिवर्तित करने की प्रक्रिया निस्तापन कहलाती है।
भर्जन– सल्फाइड अयस्कों को वायु की पर्याप्त आपूर्ति की स्थिति में तीव्रता से गर्म करके धातु को ऑक्साइड में परिवर्तित करने की प्रक्रिया को भर्जन कहते हैं।
गालक– गालक वह पदार्थ है जिसे निस्तापित या भर्जित अयस्क एवं कोक के साथ मिश्रित कर मिश्रण को गर्म किया जाता है।
धातुमल– द्रावक अयस्क में उपस्थित अद्रवणशील अपद्रव्यों के साथ संयोग करके उन्हें द्रवणशील पदार्थ में परिवर्तित कर देता है, जिसे धातुमल कहते हैं।
प्रगलन– धातु के ऑक्साइड को कोक के साथ गर्म करके उसे धातु में परिवर्तित करने की प्रक्रिया प्रगलन कहलाती है।
जस्ता या जिंक के प्रमुख अयस्क–
1. जिंक ब्लेंड (ZnS)
2. कैलेमाइन (ZnCO3)
3. जिंकाइट (ZnO)
- पारा का प्रमुख अयस्कसिनेबारहै।
ऐलुमिनियम के प्रमुख अयस्क हैं–
1. बॉक्साइट (Al2O3. 2H2O)
2. कोरंडम (Al2O3)
3. क्रायोलाइट (Na3AlF6)
संक्षारण– धातु की सतह पर वायु के ऑक्सीजन, कार्बन डाइऑक्साइड, जलवाष्प, सल्फर डाइऑक्साइड, हाइड्रोजन सल्फाइड आदि की अभिक्रिया के फलस्वरूप धातु का क्षय धातु का संक्षारण कहलाता है।
संक्षारण रोकने का उपाय–
धातु की सतह पर लेप चढ़ाकर– धातु की बाहरी सतह पर ग्रीज या वार्निश की एक पतली परत चढ़ा कर उसके संक्षारण को रोका जा सकता है।
रंगाई करके– धातु की सतह को किसी अम्ल अवरोधक रंग से रंगाई कर देने से धातुओं के संक्षारण को रोका जा सकता है।
जस्तीकरण करके– धातु की किसी पिघले हुए जस्ता में डुबा देने से वस्तु की सतह पर जस्ता की एक परत बैठ जाती है। जिससे जंग लगने से बचाया जा सकता है।
विद्युतलेपन द्वारा– वैद्युत अपघटन प्रक्रिया द्वारा किसी धातु पर किसी अन्य धातु का लेप चढ़ा कर संक्षारण से बचाया जा सकता है।
मिश्रधातु– दो या अधिक धातुओं अथवा एक धातु एवं एक अधातु का समांग मिश्रण मिश्रधातु कहलाता है।
जैसे- पीतल, ताँबा एवं जस्ता का मिश्रधातु है।
मिश्रधातु के गुण–
- ये अपने अवयवों से अधिक कठोर होते हैं।
- ये संक्षारण-अवरोधक होते हैं।
- इनके द्रवनांक एवं इनकी विद्युत चालकता उनके अवयवों की अपेक्षा कम होते हैं। जैसे पीतल विद्युत का अच्छा चालक नहीं है, जबकि इसका अवयव ताँबा विद्युत का अच्छा चालक है।
- इनकी गुणवत्ता इनके अवयवों की तुलना में बढ़ जाती है।
महत्वपूर्ण तथ्य—
- सबसे कठोर धातु प्लैटिनम होता है।
- विद्युत तथा ऊष्मा की सबसे अच्छी चालक चाँदी होती है।
- लोहा का उद्योगों की जननी कहा जाता है।
- प्लैटिनम को सफेद सोना कहा जाता है।
- यूरेनियम को पीला केक कहा जाता है।
- तांबामानव द्वारा खोजी गई सबसे पहली धातु है।
- सबसे मुलायम धातु सोडियम होता है, जिसे चाकू से आसानी से काटा जा सकता है।
- सोडियम को किरोसीन तेल में रखा जाता है।
- सबसे हल्की धातु लिथियम तथा सबसे भारी धातु ओसमियम है।
- पारा एक ऐसा धातु है, जो कमरे के ताप पर द्रव अवस्था में रहता है।
- मुक्त अवस्था में पाया जाने वाला धातु सोना, चाँदी और प्लैटिनम है।
- ब्रोमीन एक ऐसा अधातु है, जो कमरे के ताप पर द्रव अवस्था में रहता है।
- सबसे अधिक सक्रिय अधातु फ्लोरिन है।
- क्लोरिन का इलेक्ट्रॉन बंधुता सबसे अधिक होता है।
- सबसे हल्की गैस हाइड्रोजन है।
- हीलियम गैस का उपयोग गुब्बारे में किया जाता है।
- सबसे अधिक गलनांक टंगस्टन का बना होता है।
- विद्युत बल्ब का फिलामेंट टंगस्टन का बना होता है।
- विद्युत बल्ब में आर्गन और नाइट्रोजन गैस भरी जाती है।
- सिलिका एक उपधातु है।
- सांद्र हाइड्रोक्लोरिक अम्ल और सांद्र नाइट्रिक अम्ल का ताजा मिश्रण एक्वारेजिया कहलाता है।
- एंटिमनी एक उपधातु है।
- बॉक्साइट एलुमिनियम धातु का अयस्क है।
- सीसा और टिन के मिश्रधातु को सोल्डर कहा जाता है।
- पीतल एक मिश्रधातु है, जिसमें ताँबा (80 ) और जिंक (20 ) होता है।
- एलुमिनियम पर मोटी ऑक्साइड की परत बनाने की क्रिया को एनोडीकरण कहते हैं।
- चाँदी को हवा में छोड़ देने पर उस पर काले रंग की परत जम जाती है।
धातु और अधातु प्रश्नोत्तर
प्रश्न 1. गर्म जल का टैंक बनाने में ताँबे का प्रयोग होता है परंतु इस्पात (लोहे का मिश्रधातु) का नहीं, इसका कारण बताए।
उत्तर—कॉपर, स्टील की अपेक्षा अधिक सुगम ताप का सुचालक है और यह स्टील की अपेक्षा अधिक सस्ता भी होता है। इसलिए ऊर्जा बचाने के लिए गर्म पानी के टैंक को कॉपर से बनाया जाता है।
प्रश्न 2.जस्ता के दो अयस्कों के नाम एवं सूत्र लिखें।
उत्तर—जस्ता के दो अयस्क इस प्रकार हैं—
(i) जिंक ब्लेड (ZnS) तथा (ii) कैलोमाइन (ZnCO3)
प्रश्न 3 मिश्रधातु किसे कहते हैं ? दो मिश्रधातुओं के नाम एवं उपयोग लिखें।
उत्तर—किसी धातु में अन्य धातु या अधातु की एक निश्चित मात्रा मिलाकर इच्छित गुण-धर्म वाली मिश्रधातुँ प्राप्त की जा सकती हैं।
ताँबे के दो मिश्रधातु निम्नांकित हैं—पीतल और काँसा। पीतल में 80% Cu और काँसा में 90% Cu पाया जाता है।
प्रश्न 4. लोहे की वस्तुओं का जस्तीकरण क्यों किया जाता है ?
उत्तर—लोहे पर जिंक धातु की पतली पर चढ़ाने की क्रिया को जस्तीकरण कहते हैं। जिंक की पतली परत चढ़ाए गए लोहे को गैल्वेनीकृत लोहा कहते हैं। इसका अधिकांश उपयोग लोहे की बाल्टी एवं पाइप आदि बनाने में होता है। लोहा को कॉपर से गैल्वेनीकृत नहीं कर सकते हैं, क्योंकि लोहा कॉपर की अपेक्षा अधिक क्रियाशील है।
प्रश्न 5. अयस्क और खनिज में अंतर लिखिए।
उत्तर—
| खनिज | अयस्क |
| (i) धातुओं के प्राकृत यौगिक रूप को खनिज कहते हैं। अधिकांश धातुए हमें यौगिकों के रूप में ही प्राप्त होती हैं, जैसे- ताँबा हमें पाइराइट या क्यूपराइट से प्राप्त होता है। (ii) सभी खनिज अयस्क नहीं होते हैं। | (i) जिन पदार्थो (खनिजों) से धातु का निष्कर्षण सरल हो उन्हें अयस्क कहते हैं, जैसे-एल्युमिनियम का अयस्क बॉक्साइट है तो लोहे का हैमेटाइट। (ii) सभी अयस्क खनिज होते हैं। |
प्रश्न 6. (i) क्या होता है, जब धातुएँ जल के साथ अभिक्रिया करती हैं ?
(ii) क्या होता है जब धातुओं का वायु में दहन होता है ?
उत्तर—(i) धातुएँ जल के साथ अभिक्रिया कर अधिक मात्रा में ऊष्मा उत्पन्न करती है। CaO जल के साथ तीव्रता से अभिक्रिया कर बूझे हुए चूने Ca (OH)2 का निर्माण करके अधिक मात्रा में ऊष्मा उत्सर्जित करती है। यह संयोजन अभिक्रिया है।
(ii) धातुओं को वायु में जलाने पर वे वियोजित होती हैं।
CaCO3 → CaO + CO2
ऊष्मा देने पर कैल्सियम कार्बोनेट, कैल्सियम ऑक्साइड तथा कार्बन डाइऑक्साइड में वियोजित हो जाती है। यह प्रमुख वियोजन अभिक्रिया है।
प्रश्न 7. एक मिश्रधातु क्या है ? मैग्नेलियम नामक मिश्रधातु के अवयवों के नाम लिखिए। इसके काई दो उपयोग दीजिए।
उत्तर—यह दो या दो से अधिक धातुओं अथवा धातु तथा अधातु का समांगी मिश्रण है। उदाहरण- पीतल, ताँबा तथा जिंक की मिश्रधातु है। कांसा, ताँबा तथा टिन की मिश्रधातु है।
मैग्नेलियम का संघटन—ऐलुमिनियम (Al)-95% और मैग्नीशियम (Mg)-5%
मैग्नेलियम के उपयोग-
- हल्की तथा कठोर होने के कारण यह हवाई जहाज के भाग बनाने में प्रयोग की जाती है।
- यह वाहनों तथा तुलाओं के भाग बनाने में काम आती है।
प्रश्न 8. लोहे को जंग से बचाने के दो उपाय बताइए।
अथवा, आयरन के जंगीकरण को रोकने के लिए दो विधियों का उल्लेख करें।
उत्तर—(a) यशदलेपन- इस प्रक्रिया में लोहे की वस्तुओं के ऊपर जिंक की एक परत चढाई जाती है।
(b) पेंटिंग- इस प्रक्रिया में लोहे की वस्तुओं पर पेंट किया जाता है।
प्रश्न 9. ध्वानिक (सोनोरस) किसे कहते हैं ?
उत्तर—कुछ धातुएँ किसी कठोर सतह से टकराकर एक विशेष प्रकार की ध्वनि उत्पन्न करती है। जिसे धातुई ध्वनि कहते हैं। इस प्रकार की धातुएँ ध्वानिक (सोनोरस) कहलाती है। जैसे-लोहा, ताँबा आदि।
प्रश्न 10. सोडियम को किरोसीन तेल में डुबोकर क्यों रखा जाता है ?
उत्तर—सोडियम सक्रिया धातु है जो वायु में उपस्थित ऑक्सीजन से क्रिया करके सोडियम ऑक्साइड बनाती है। यह पानी से क्रिया कर सोडियम हाइड्रोक्साइड तथा हाइड्रोजन बनाती है। यह पानी से क्रिया कर सोडियम हाइड्रोक्साइड तथा हाइड्रोजन उत्पन्न करती है। वायु में खुला छोड़ देने पर यह आग पकड़ लेती है। इसलिए, इसे मिटटी के तेल में डुबोकर सुरक्षित रखते हैं।
प्रश्न 11. खनिज और अयस्क क्या हैं ? लोहे के दो अयस्कों के नाम उनके आणविक सूत्र के साथ लिखें।
उत्तर—खनिज : ऐसे प्राकृतिक पदार्थ जिनमें धातुएँ अपने यौगिकों के रूप में होती हैं, खनिज कहलाते हैं। जैसे- फैल्सपार, अभ्रक आदि।
अयस्क: इन खनिजों को जिनसे लाभप्रद ढंग से धातुओं का निष्कर्षण किया जाता है, अयस्क कहलाते हैं। जैसे- हेमेटाइट , बॉक्साइट आदि।
लोहे के दो मुख्य अयस्क के नाम एक आण्विक सूत्र निम्नलिखित है-
(i) हेमेटाइट (Fe2O3) एवं (ii) आयरन पाइराइट (FeS2)
प्रश्न 12. संयोजी इलेक्ट्रॉन क्या है ? सोडियम परमाणु में स्थित संयोजी इलेक्ट्रॉन की संख्या लिखें।
उत्तर—संयोजी इलेक्ट्रॉन— परमाणु के बाहरी कक्षा में उपस्थित इलेक्ट्रॉन की संख्या को संयोजी इलेक्ट्रॉन कहते हैं। सोडियम परमाणु में स्थित संयोजी इलेक्ट्रॉन की संख्या 1 है।
कोर इलेक्ट्रॉन— परमाणु के सबसे बाहरी कक्षा के छोड़कर शेष सभी कक्षाओं में उपस्थित इलेक्ट्रॉनों की कुल संख्या को कोर इलेक्ट्रॉन कहते हैं। सोडियम परमाणु में उपस्थित कोर इलेक्टृॉनों की संख्या 10 है।
प्रश्न 13. धातुकर्म क्या है ? इसके विभिन्न चरणों को लिखें।
उत्तर—धातुकर्म वह विधि है जिसके द्वारा अयस्क से शुद्ध धातु का निषकर्षण होता है।
अयस्क से शुद्ध धातु का निष्कर्षण निम्नांकित कई चरणों में होता है-
- अयस्कों का समृद्धीकरण – अयस्कों से गैंग को हटाने की प्रक्रिया को समृद्धीकरण कहते हैं।
- धातुओं का निष्कर्षण – इसके लिए निस्तापन, भर्जन, अपघटन आदि विधि का प्रयोग होता है।
- धातुओं का परिष्करण – अशुद्ध धातुओं को विभिन्न विधियों, जैसे- विद्युत अपघटनी परिष्करण द्वारा शुद्ध किया जाता है।
प्रश्न 14. आपने ताँबा के मलीन बर्तन को नींबु या इमली के रस से साफ करते अवश्य देखा होगा। ये खट्टे पदार्थ बर्तन का साफ करने में क्यों प्रभावी हैं ?
उत्तर—ताँबा ऑक्साइड अम्लों से अभिक्रिया करता है, किन्तु ताँबा को स्वयं अभिक्रिया नहीं करता। अत: ताँबे को अम्लीय पदार्थों द्वारा साफ किया जा सकता है। ये ताँबे के संरक्षित हिस्सों (कॉपर ऑक्साइड) को अलग कर देता है तथा शुद्ध ताँबा बचा रह जाता है।
प्रश्न 15. गैल्वनीकरण किसे कहते हैं ?
उत्तर—लोहे की बनी वस्तुओं को पिघले हुए जिंक में डुबो देने से या विद्युत विधि द्वारा लोहे पर एक बारिक जिंक की परत चढ़ाने की प्रक्रिया गैल्वनीकरण कहलाती है।
प्रश्न 16. ऐसी धातु का उदाहरण दीजिए जो
(i) कमरे के ताप पर द्रव होती है।
(ii) चाकू से आसानी से काटी जा सकती है।
(iii) ऊष्मा की सबसे अच्छी चालक होती है।
(iv) ऊष्पा की कुचालकं होती है।
उत्तर—(i) पारा, (ii) सोडियम, (iii) चाँदी, (iv) सीसा (लेड)
प्रश्न 17. आघातवर्ध्य तथा तन्य का अर्थ बताइए।
उत्तर—धातुओं का वह गुण, जिसके कारण हथौड़े से पीटकर उन्हें चदरे के रूप में बदला जा सके ‘आघातवर्ध्य’ कहलाता है। जैसे सोना, चाँदी, ऐलुमिनियम, कॉपर इत्यादि।
धातुओं का वह गुण जिसके कारण उनको तार के रूप में बनाया जा सके, ‘तन्य’ कहा जाता है। जैसे- सोना, चाँदी, ऐलुमिनियम, कॉपर।
प्रश्न 18. सोडियम को किरोसिन में डुबो कर क्यों रखा जाता है?
उत्तर—चूँकि सोडियम साधारण तापमान पर जल तथा ऑक्सीजन के साथ तीव्र गति से प्रतिक्रिया करता है, लेकिन यह किरोसिन के साथ किसी प्रकार की प्रतिक्रिया नहीं करता है, इसलिए सोडियम को किरोसिन में डुबो कर रखा जाता है।
प्रश्न 19. इन अभिक्रियाओं के लिए समीकरण लिखिए :
(i) भाप के साथ आयरन।
(ii) जल के साथ कैल्सियम तथा पोटैशियम।
उत्तर : (i) 2Fe + 3H2O → Fe2O3 + 3H2
(ii) Ca + 2H2O → Ca(OH)2 + H2
2K + 2H2O → 2KOH + H2 +
प्रश्न 20. जिंक को आयरन सल्फेट के विलयन में डालने से क्या होता है ? इसकी रासायनिक अभिक्रिया लिखिए।
उत्तर – जिंक को आयरन सल्फेट के विलयन में डालने से जिंक, आयरन सल्फेट से आयरन को विस्थापित कर देता है। क्योंकि Zn, Fe से ज्यादा क्रियाशील है।
Zn + FeSO4 → ZnSO4+ Fe
प्रश्न 21. (i) सोडियम, ऑक्सीजन एवं मैग्नीशियम के लिए इलेक्ट्रॉन बिंदु संरचना लिखिए।
(ii) इलेक्ट्रॅन के स्थानांतरण के द्वारा Na2O एवं MgO का निर्माण दर्शाइए।
(iii) इन यौगिको में कौन से आयन उपस्थित हैं।
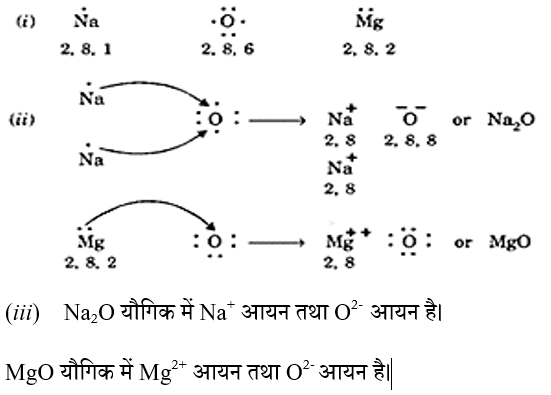
प्रश्न 22. आयनिक यौगिकों का गलनांक उच्च क्यों होता है ?
उत्तर—आयनिक यौगिक का रूप ठोस तथा कठोर होता है। इस अवस्था में आयनों के बीच का आकर्षण बल काफी मजबूत होता है। जब इन्हें द्रवों (घुलनशील पदार्थ) में डाला जाता है तो इनके बीच आकर्षण बल कम हो जाता है। अत्यधिक मात्रा में ऊर्जा की आवश्यकता पड़ती है। इस आधार पर हम कह सकते हैं कि आयनिक यौगिकों का द्रवणांक उच्च होता है।
प्रश्न 23. निम्न पदों की परिभाषा दीजिए :
(i) खनिज (ii) अयस्क (iii) गैंग
उत्तर—(i) खनिज— पृथ्वी की भूपर्पटी में प्राकृतिक रूप से पाये जानेवाले तत्वों अथवा यौगिकों को खनिज कहते हैं।
(ii) अयस्क– कुछ स्थानों पर खनिजों में कोई विशेष धातु अत्यधिक मात्रा में पाई जाती हैं, जिनसे कम खर्च तथा आसानी से धातुएँ प्राप्त की जाती हैं, उन खनिजों को अयस्क कहते हैं।
(iii) गैंग – खनिजों या अयस्कों में जो मिट्टी तथा रेत जैसी कई अशुद्धियाँ मिली हुई होती हैं, वे गैंग कहलाती हैं।
प्रश्न 24. दो धातुओं के नाम बताइए जो प्रकृति में मुक्त अवस्था में पाई जाती हैं।
उत्तर – सोना और प्लैटिनम धातु प्रकृति में मुक्त अवस्था में पाई जाती है।
प्रश्न 25. धातु को उसके ऑक्साइड से प्राप्त करने के लिए किस रासायनिक प्रक्रम का उपयोग किया जाता है ?
उत्तर—धातु को उसके ऑक्साइड से प्राप्त करने के लिए कार्बन द्वारा अपचयन के रासायनिक प्रक्रम का उपयोग किया जाता है।
प्रश्न 26. कौन-सी धातुएँ आसानी से संक्षारित नहीं होती हैं और क्यों?
उत्तर—सोना तथा चाँदी आसानी से संक्षारित नहीं होती हैं क्योंकि इन धातुओं की सक्रियता बहुत ही कम होती है
प्रश्न 27. मिश्रधातु (मिश्रातु) क्या होते हैं ?
उत्तर—दो अथवा दो से अधिक धातुओं के मिश्रण को मिश्रधातु कहते हैं। ताँबा और जस्ते की मिश्रधातु पीतल, टिन तथा ताँबा की मिश्रधातु काँसा। शुद्ध धातुओं की अपेक्षा उनकी मिश्रधातु की विद्युत चालकता तथा गलनांक कम होते हैं।
प्रश्न 28. उभयधर्मी ऑक्साइड क्या होते हैं? दो उभयधर्मी ऑक्साइडों का उदाहरण दीजिए।
उत्तर—जो ऑक्साइड अम्ल तथा क्षार दोनों से अभिक्रिया करके लवण तथा जल का निर्माण करता है उन्हें उभयधर्मी ऑक्साइड कहते हैं। ऐसे ऑक्साइड अम्लीय तथा क्षारीय दोनों जैसा गुण रखते हैं। जिंक ऑक्साइड (ZnO) तथा ऐलुमिनियम ऑक्साइड (Al2O3) उभयधर्मी ऑक्साइड के उदाहरण हैं।
प्रश्न 29. लोहे को जंग से बचाने के लिए दो तरीके बताइए।
उत्तर—लोहे को जंग से बचाने के लिए दो तरीके :
(i) पेंटिंग– जंग से बचाने के लिए लोहा के वस्तुओं पर पेंट किया जाता है।
(ii) जिंक लेपन – जंग से बचाने के लिए लोहा की वस्तुओं पर जिंक की परत चढ़ाई जाती है।
प्रश्न 30. ऑक्सीजन से संयुक्त होकर अधातुएँ कैसा ऑक्साइड बनाती हैं ?
उत्तर– ऑक्सीजन से संयुक्त होकर अधातुएँ क्षारीय तथा उभयधर्मी ऑक्साइड बनाती हैं।
प्रश्न 31. कारण बताइए :
(a) प्लैटिनम, सोना एवं चाँदी का उपयोग आभूषण बनाने के लिए किया जाता है।
(b) सोडियम, पोटैशियम एवं लीथियम को किरोसिन तेल के अंदर संग्रहीत किया जाता है।
(c) ऐलुमिनियम अत्यंत अभिक्रियाशील धातु है, फिर भी इसका उपयोग खाना बनानेवाले बरतन बनाने के लिए किया जाता है।
(d) निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड अयस्क को ऑक्साइड में परिवर्तित किया जाता है।
उत्तर :
(a) प्लैटिनम, सोना तथा चाँदी आदि धातुओं की अभिक्रियाशीलता बहुत कम है, इसलिए ये संक्षारित नहीं होती हैं और उनकी चमक अधिक होती है और अधिक दिनों तक कायम रहती हैं। इन्हीं कारणों से इनके आभूषण बनाये जाते हैं।
(b) चूँकि Na, K तथा Li बहुत ही अधिक अभिक्रियाशील हैं इसलिए ये जल तथा O से जल्द ही अभिक्रिया करके अपने ऑक्साइड बनाते हैं। इनको खुली हवा में रखने से ही इनमें आग पकड़ लेती है। इस कारण इन्हें किरोसिन तेल के अन्दर डुबोकर संग्रहित किया जाता है।
(c) ऐलुमिनियम ऊष्मा का सुचालक होता है और साथ ही यह संक्षारित भी नहीं होता। इसी कारण ऐलुमिनियम के बर्तन में खाना बनाया जाता है।
(d) चूँकि अपचयन से पहले धातु को सल्फाइड तथा कार्बोनिट को धातु ऑक्साइड में बदला जाता है क्योंकि उसके ऑक्साइड से धातु प्राप्त करना ज्यादा आसान होता है।
प्रश्न 32. आपने ताँबे के मलीन बरतन को नींबू या इमली के रस से साफ करते अवश्य देखा होगा। ये खट्टे पदार्थ बरतन को साफ करने में क्यों प्रभावी हैं ?
उत्तर—चूँकि ताँबा स्वयं अम्लों से प्रतिक्रिया नहीं करता है लेकिन ताँबा के ऑक्साइड अम्लों से प्रतिक्रिया (अभिक्रिया) करता है। इसलिए ताँबा को अम्लीय पदार्थों जैसे नींबू या इमली के रस से साफ किया जाता है।
प्रश्न 33. गर्म जल का टैंक बनाने में ताँबे का उपयोग होता है परंतु इस्पात (लोहे की मिश्रातु) का नहीं। इसका कारण बताइए।
उत्तर—चूँकि ताँबा के साथ जल अभिक्रिया नहीं करता है जबकि गर्म लोहा उबलता पानी से प्रतिक्रिया करता है तथा शीघ्र ही संक्षारित हो जाता है। इस कारण गर्म हुआ जल का टैंक इस्पात का न बनाकर ताँबा का बनाया जाता है।
प्रश्न 34. मिश्रधातु किसे कहते हैं? इसके दो उदाहरण दें। मिश्रधातु के तीन उपयोगों का वर्णन करें।
अथवा, मिश्रधातु क्या होती है ? इन्हें कैसे तैयार किया जाता है? काँसा तथा अमलगम मिश्रधातु में उपस्थित धातओं के नाम बताएँ। इन मिश्र धातुओं के एक-एक उपयोग लिखें।
उत्तर— मिश्रधातु– यह दो या दो से अधिक धातुओं अथवा तथा अधातु का संभागी मिश्रण है। जैसे-पीतल, ताँबा तथा जिंक की मिश्रधातु है, कांसा, ताँबा तथा टिन की मिश्रधातु हैं।
उदाहरण :
(i) सोडियम अमलगम (Na + Hg)
(ii) टीन अमलगम (Sn + Hg)
मिश्रधातुओं के उपयोग-
(i) कठोरता बढ़ाने के लिए- लोहे में कार्बन की मात्रा मिलाकर स्टेनलैस स्टील बनाया जाता है जो लोहे से अधिक कठोर होता है। सोने में ताँबा तथा चाँदी में सीसा मिलाने से उनकी कठोरता अधिक हो जाती है। ड्यूरेलियम एल्युमिनियम से बना मिश्रधातु है जो अत्यधिक कठोर होता है।
(ii) शक्ति बढ़ाने के लिए- इस्पात, ड्यूरेलियम आदि मिश्रधातु कठोर होने के कारण शक्तिशाली भी होते हैं।
(iii) संक्षारण रोकने के लिए- जैसे स्टैनलेस स्टील, लोहे तथा जिंक से बनी मिश्रधात आदि पर जंग नहीं लगता।
You must watch ….
Bihar Board Class 10 Science Chemistry Solution
- Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण
- Chapter 2 अम्ल, क्षारक एवं लवण
- Chapter 4 कार्बन एवं इसके यौगिक
- Chapter 5 तत्वों का आवर्त वर्गीकरण
Bihar Board Class 10 Science Biology Solution
- Chapter 1 जैव प्रक्रम
- Chapter 2 नियंत्रण एवं समन्वय
- Chapter 3 जीव जनन कैसे करते है
- Chapter 4 अनुवांशिकता एवं जैव विकास
- Chapter 5 उर्जा के स्रोत
- Chapter 6 हमारा पर्यावरण
- Chapter 7 प्राकृतिक संसाधनों का प्रबंधन
