तत्वों का आवर्त वर्गीकरण
तत्त्वों के आवर्ती वर्गीकरण की आवश्यकता क्यों ?
प्रारंभ में जब बहुत ही कम तत्त्व ज्ञात थे तब उनके गुणों का अलग-अलग अध्ययन करने में कोई विशेष कठिनाई नहीं होती थी। किंतु जब एक-एक करके बहुत-से तत्त्वों का आविष्कार हुआ तो उनके गुणों का अलग-अलग अध्ययन करने में कठिनाई महसुस होने लगी। अब तक 111 तत्त्वों का आविष्कार हो चुका है।
तत्त्वों के वर्गीकरण के लाभ-
तत्त्वों के वर्गीकरण से निम्नलिखित लाभ प्राप्त होते हैं-
1. इसमें तत्त्वों के गुणों का अध्ययन नियमित तरीके से किया जा सकता है।
2. सभी तत्त्वों के गुणों का अलग-अलग अध्ययन करने की आवश्यकता नहीं पड़ती है। किसी समुह के एक विशिष्ट तत्त्व के गुणों की जानकारी हो जाने पर उस समुह के अन्य तत्त्वों के गुणों का अनुमान लगाया जा सकता है।
3. किसी समूह के तत्त्वों के गुणों में होने वाले क्रमिक परिवर्तन को समझना आसान हो जाता है।
4. इससे विभिन्न समुहों के तत्त्वों के पारस्परिक संबंध की जानकारी प्राप्त की जा सकती है।
डोबरेनर के त्रियक-
19वीं शताब्दी के प्रारंभ में जर्मन रसायनज्ञ जॉन डोबरेनर ने रासायनिक दृष्टि से सदृश तत्त्वों को तीन-तीन समूहों में वर्गीकृत किया। ये समुह त्रियक कहलाते हैं। इन्होंने त्रियक के नियम की घोषणा की।
त्रियक नियम के अनुसार-
त्रियक के तत्त्वों को उनके परमाणु द्रव्यमानों के क्रम में सजाने पर मध्यवर्ती तत्त्व का परमाणु द्रव्यमान किनारे वाले शेष दोनों तत्त्वों के परमाणु द्रव्यमानों का औसत होता है।
इसे ‘डोबरेनर का त्रियक’ भी कहते हैं।
न्यूलैंड्स का अष्टक नियम- यदि तत्त्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाया जाए तो किसी भी तत्त्व से प्रारंभ करने पर आठवें तत्त्व के गुण पहले तत्त्व के गुणों के समान होते हैं, जैसा कि संगीत का आठवाँ स्वर पहले स्वर के समान होता है।
अष्टक के दोष-
1. न्यूलैंड्स का अष्टक नियम हल्के तत्त्वों (कैल्सियम तक) के लिए ही लागु होता है, भारी तत्त्वों के लिए नहीं, क्योंकि कैल्सियम के बाद प्रत्येक आठवें तत्त्व के गुण प्रथम तत्त्व के गुण से भिन्न होते हैं।
2. न्यूलैंड्स का अनुमान था कि प्रकृति में सिर्फ 56 तत्त्व ही हैं और आगे चलकर अन्य तत्त्वों का आविष्कार नहीं होगा। किंतु, यह अनुमान गलत निकला। आगे चलकर अन्य बहुत-से नए तत्त्वों के आविष्कार हुए जिनके आचरण अष्टक नियम के प्रतिकुल थे।
3. अक्रिय गैसों का आविष्कार हो जाने पर नवम् तत्त्व प्रथम तत्त्व के समान गुण वाला होता है, न कि आठवाँ।
मेंडलीव का आवर्त नियम-
न्यूलैंड्स के अष्टक नियम से प्रेरित होकर 1869 में रूसी रसायनज्ञ दमित्री मेंडलीव ने तत्त्वों के भौतिक और रासायनिक गुणों का गहन अध्ययन करके तत्त्वों के वर्गीकरण की एक नई प्रणाली विकसित की। तत्त्वों के उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाकर उन्होंने देखा कि
1. तत्त्वों के गुणों में क्रमिक परिवर्तन होता है,
2. तत्त्वों के एक निश्चित संख्या के बाद लगभग समान गुणवाले तत्त्व पाए जाते हैं।
अपने निष्कर्षों के आधार पर मेंडलीव ने एक नियम का प्रतिपादन किया जिसे मेंडलीव का आवर्त नियम कहते हैं।
मेंडलीव के आवर्त नियम के अनुसार-
तत्त्वों के भौतिक व रासायनिक गुण उनके परमाणु द्रव्यमानों के आवर्तफलन होते हैं, दूसरे शब्दों में यदि तत्त्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में सजाया जाए तो एक निश्चित संख्या के बाद समान गुणवाले तत्त्व पाए जाते हैं।
मेंडलीव की आवर्त सारणी की मुख्य विशेषताएँ-
1. वर्ग और उपवर्ग
आवर्त सारणी की उदग्र स्तंभों को वर्ग कहते हैं। इन्हें रोमण अंकों द्वारा निरूपित किया गया है। प्रत्येक वर्ग को A और B , दो उपवर्गों में बाँटा गया है। वर्गों की कुल संख्या 9 होती है।
2. आवर्त
आवर्त सारणी की क्षैतिज कतारें आवर्त कहलाती हैं। सारणी में 1 से लेकर 7 तक कुल सात आवर्त हैं।
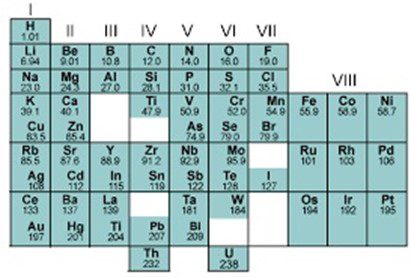
मेंडलीव के आवर्तन सारणी की विशेषताएँ—
1. इस आवर्त सारणी से तत्त्वों का अध्ययन करना काफी आसान हो गया।
2. मेंडलीव के आवर्त सारणी में कुल 63 तत्व थे। भविष्य में नए तत्त्वों की खोज के लिए मेंडलीव सारणी में रिक्त स्थान रख छोड़ा था। उन्होंने नए तत्त्वों की रासायनिक संरचना के बारे में भी भविष्यवाणी की थी।
3. मेंडलीव के कुछ तत्त्व के परमाणु द्रव्यमान गलत निकाले गए थे, जिसे आगे चलकर सुधारा गया।
मेंडलीव के आवर्त सारणी के दोष-
1. मेंडलीव के आवर्त सारणी में हाइड्रोजन के स्थान का निर्धारण नहीं किया गया था।
2. मेंडलीव के आवर्त सारणी परमाणु द्रव्यमानों के क्रम में सजाया गया था, लेकिन कुछ तत्त्व इस पद्धति का पालन नहीं किया है। जैसे- आर्गन (40) को पोटैशियम (39) से पहले रखा गया है।
3. आठवें वर्ग में तीन-तीन तत्त्व को एक ही स्थान में रखा गया है।
4. समान गुणों वाले तत्वों को अलग-अलग जबकि असमान गुणों वाले तत्वों को एक साथ रखा गया है।
5. मेंडलीव के आवर्त सारणी में समस्थानिकों के लिए कोई व्यवस्था नहीं थी।
मोसले का आवर्त नियम-
- तत्त्वों के भौतिक एवं रासायनिक गुण उनकी परमाणु संख्याओं के आवर्तफलन होते हैं।
- मोसले ने आधुनिक आवर्त सारणी का निमार्ण परमाणु द्रव्यमान पर नहीं, बल्कि परमाणु संख्याओं के आधार पर किया।
- परमाणु संख्या के आधार पर तत्त्वों को सजाकर आवर्त सारणी को संशोधित रूप में प्रस्तुत किया जिसे आधुनिक आवर्त सारणी कहते हैं। इसे आवर्त सारणी का दीर्घ या वृहद रूप भी कहते हैं।
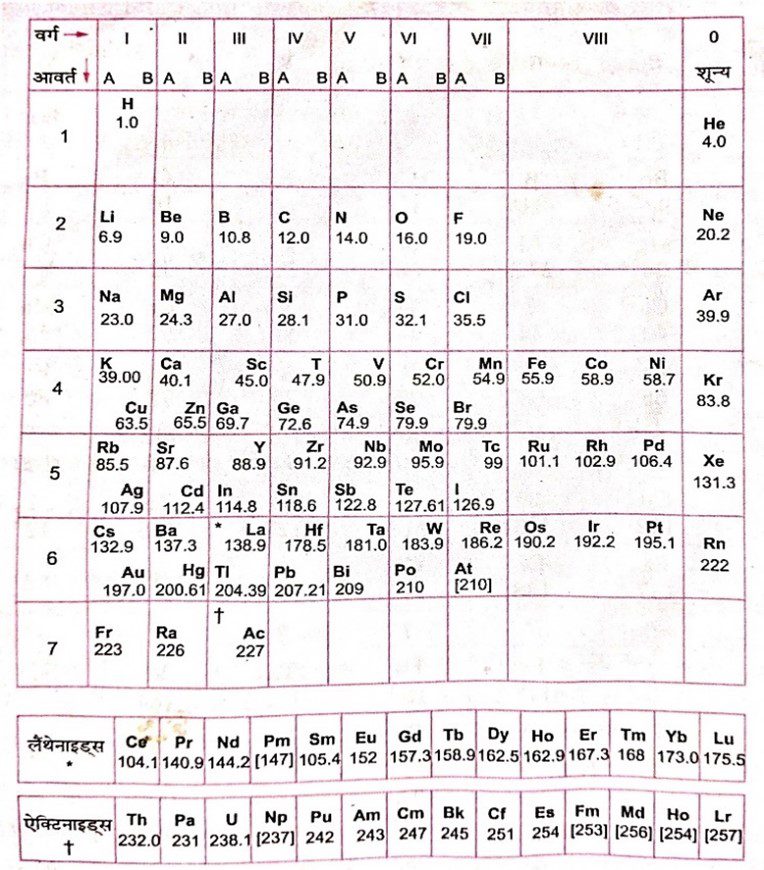
आधुनिक आवर्त सारणी का विवरण
1. आधुनिक आवर्त सारणी में तत्त्वों को उनकी बढ़ती हुई परमाणु संख्या के क्रम में सजाया गया है।
2. इसमें कुल सात आवर्त हैं।
3. आधुनिक आवर्त सारणी में लैंथेनाइड्स एवं ऐक्टिनाइड्स को छोड़कर 18 उदग्र स्तंभ है। ये 1, 2, 3, 4, ….., 18 संख्याओं द्वारा व्यक्त किए गए हैं।
4. इस आवर्त सारणी के नीचे दो कतारों में लैथेंनाइड्स और ऐक्टिनाइड्स हैं। ये वर्ग 3 के सदस्य हैं।
लैंथेनाइड्स : La (57), Ce (58) – Lu (71)
ऐक्टिनाइड्स : Ac (89), Th (90) – Lr (103)
इस आवर्त सारणी को चार ब्लॉकों में बाँट दिया गया है। ये चार ब्लॉक हैं- s, p, d और f
आवर्त सारणी की विशेषताएँ-
1. इलेक्ट्रॉनिक विन्यास-किसी वर्ग-विशेष के सभी तत्त्वों के बाह्य इलेक्ट्रॉनिक विन्यास समान होते हैं, अर्थात सभी तत्त्वों के परमाणुओं में संयोजी इलेक्ट्रॉनों की संख्या समान होती है।
2. संयोजकता-किसी वर्ग के सभी तत्त्वों की संयोजकता समान होती है।
3. परमाणु का आकार या त्रिज्या-आवर्त सारणी के किसी वर्ग में ऊपर से नीचे आने पर परमाणु का आकार बढ़ता जाता है।
4. धातुई गुण-किसी वर्ग में ऊपर से नीचे आने पर तत्त्व का धातुई गुण बढ़ने लगता है।
5. भौतिक गुण-किसी वर्ग में ऊपर से नीचे आने पर धातुई तत्त्वों के भौतिक गुण (द्रवनांक, क्वथनांक आदि) क्रमशः घटते जाते हैं, किंतु घनत्व में बढ़ने की प्रवृति होती है।
वर्ग में ऊपर से नीचे आने पर अधातुओं के भौतिक गुण क्रमशः बढ़ते जाते हैं।
6. आधुनिक आवर्त सारणी के दोष-आधुनिक आवर्त सारणी में मेंडलीव की आवर्त सारणी के अधिकांश दोष दूर कर दिए गए हैं, फिर भी इसमें निम्नलिखित दोष रह गए हैं-
7. हाइड्रोजन का स्थान-इस आवर्त सारणी में भी मेंडलीव की सारणी की भाँति हाइड्रोजन का स्थान अनिर्णित है।
8. हीलियम का स्थान-इलेक्ट्रॉनिक विन्यास के अनुसार हीलियम का स्थान वर्ग 2 में क्षारीय मृदा धातुओं के साथ होना चाहिए था, किंतु इसे उत्कृष्ट गैसों के साथ वर्ग 18 में रख दिया गया है।
- आवर्त सारणी के वर्ग 0 या वर्ग 18 वाले तत्त्व गैस है जिन्हें उत्कृष्ट गैसें कहते हैं। ये सभी तत्त्व रासायनिक दृष्टि से अक्रिय होते हैं।
महत्वपूर्ण तथ्य—
- वर्ग 1 के तत्त्व क्षार धातु कहलाते हैं।
- वर्ग 2 के तत्त्व क्षारीय मृदा धातु कहलाते हैं।
- वर्ग 17 के तत्त्व हैलोजन्स कहलाते हैं।
- आधुनिक आवर्त सारणी के जनक मोसले को कहा जाता है।
- सर्वप्रथम आवर्त सारणी मेंडलीव ने बनाया था। इसलिए मेंडलीव को आवर्त सारणी का जनक कहा जाता है।
- आवर्त सारणी में दाएँ से बाएँ क्षैतिज भाग को आवर्त कहते हैं तथा आवर्त सारणी में ऊपर-नीचे उर्ध्वाधर रेखा के बने भाग को वर्ग कहते हैं।
- वायुयान के टायर और गोताखोर के सीलेंडर में हीलियम गैस भरा जाता है।
- चमकिले प्रकाश के लिए नियॉन का प्रयोग किया जाता है। जैसे- टेस्टर
- बंद पैकेटों में नाइट्रोजन गैस भरा जाता है।
- आवर्त सारणी में बाएँ से दाएँ जाने पर परमाणु आकार घटता है, तथा ऊपर से नीचे आने पर बढ़ता है।
- आवर्त सारणी में बाएँ से दाएँ जाने पर धातुई गुण घटता है, तथा ऊपर से नीचे आने पर बढ़ता है।
- न्यूलैंड्स के अष्टक सिद्धांत की मुख्य कमी यह थी कि यह केवल हल्के तत्त्वों के लिए ही ठीक से लागू हो पाया। भारी तत्वों के संबंध में यह सही नहीं उतरा।
- किसी कोश (कक्षा) में इलेक्ट्रॉनों की अधिकतम संख्या 2n2 होती है।
- आधुनिक आवर्त सारणी के क्षैतिज कतारों को आवर्त कहा जाता है। जबकि उदग्र कतारों को समूह कहते हैं।
- आवर्त सारणी में बाएँ से दाएँ जाने पर अधातुई गुण बढ़ता है, तथा ऊपर से नीचे आने पर घटता है।
- आधुनिक आवर्त सारणी में तत्वों के गुणधर्म उनके परमाणु संख्या के आवर्त फलन होते हैं।
प्रश्न 1. मेंडलीफ के आवर्त सारणी के विसंगतियों को लिखें।
अथवा , आधुनिक आर्वत सारणी द्वारा किस प्रकार से मेंडलीफ के आर्वत सारणी की विविध विसंगतियों को दूर किया गया ?
उत्तर—मेंडलीफ के आवर्त सारणी के विसंगतियाँ हैं –
(i) आधुनिक आवर्त सारणी में हाइड्रोजन का प्रथम समूह में तर्क संगत स्थान है, क्योंकि हाइड्रोजन विद्युत धनात्मक होता है।
(ii) आधुनिक आवर्त सारणी में तत्वों को उनके बढ़ते हुए परमाणु संख्या के क्रम में रखा गया है इसलिए किसी तत्व के समस्थानिकों को तत्व के साथ उसी स्थान पर आवर्त्त सारणी में रखा गया है।
(iii) भारी एंव हल्के तत्वों का क्रम भी आधुनिक आवर्त्त सारणी में सही है जो मेन्डेलीफ के आवर्त्त सारणी में नहीं था।
(iv) अक्रिया गौसों का स्थान भी तर्कसंगत 18वें समूह में हैं।
प्रश्न 2. उत्कृष्ट गैसों को अलग समूह में क्यों रखा गया है ?
उत्तर—उत्कृष्ट गैसों को अलग समूह में रखा गया है, क्योंकि ये अक्रिय होती हैं और अन्य किसी भी तत्व या यौगिक से अभिक्रिया नहीं करती हैं।
प्रश्न 3. निष्क्रय गैसीय तत्वों की आवर्त्त सारणी के शून्य वर्ग में क्यों रखा गया है ?
अथवा, उत्कृष्ट गैसों को अलग समूह में क्यों रखा गया है?
उत्तर—इस परिवार के सदस्यों को शून्य वर्ग में रखा गया है। वास्तव में, ये सभी सदस्य 0 संयोजकता प्रदर्शित करते हैं। इसका अर्थ यह है कि ये अन्य तत्वों के साथ संयोजित प्रवृति नहीं रखते। हीलियम के संयोजकता शैल (केवल एक ही शैल ) में 2 इलेक्ट्रॉन हैं। अन्य परिवार से सदसयों के संयोजकता शैल में आठ-आठ इलेक्ट्रॉन होते हैं। संयोजकता (8-संयोजकता इलेक्ट्रॉनों की संख्या ) के बराबर होती है। इसलीए ये शून्य संयोजकता प्रदर्शित करते हैं।
प्रश्न 4. न्यूलैंड के अष्टक सिद्धांत की क्या सीमाएँ हैं ?
उत्तर—न्यूलैंड के अष्टक सिद्धांत की सीमाएँ हैं—
(i) अष्टक का सिद्धांत केवल कैल्सियम तक ही लागु होता था, क्योंकि कैल्सियम के बाद प्रत्येक आठवें तत्व का गुणर्धम पहले तत्व से नहीं मिलता।
(ii) बाद में कई नये तत्व पाये गये जिनके गुणधर्म अष्टक सिद्धांत से नहीं खाते थे।
(iii) अपनी सारणी में इन तत्वों को समंजित करने के लिए न्यूलैंड ने दो तत्वों को एक साथ रख दिया और कुछ असमान तत्वों को एक स्थान में रख दिया।
उदाहरण- कोबाल्ट तथा निकेल एक साथ हैं तथा इन्हें एक साथ उसी स्तम्भ में रखा गया है जिनमें फ्लुओरीन, क्लोरीन एंव ब्रोमीन हैं यद्यपि इनके गुणधर्म उन दोनों तत्वों से भिन्न हैं। आयरन को कोबाल्ट एंव निकेल से दूर रखा गया है जबकि उनके गुणधर्मों में समानता होती हैं।
दीर्घ उत्तरीय प्रश्नोत्तर
प्रश्न 3. मेंडलीफ के आवर्त्त सारणी और आधुनिक आवर्त्त सारणी में क्या अन्तर है?
अथवा, आधुनिक आवर्त्त सारणी एवं मेंडेलीफ की आवर्त्त सारणी में तत्वों की व्यवस्था की तुलना कीजिए।
उत्तर—
| मेंडेलीफ की आवर्त्त सारणी | आधुनिक आवर्त्त सारणी |
| (i) तत्वों को बढ़ते परमाणु द्रव्यमानों में व्यवस्थित किया गया है। (ii) इस आवर्त सारणी में ऊर्ध्वाधर स्तंभ केवल 8 है जो कि वर्ग कहलाते हैं। (iii) सभी संक्रमण तत्वों को एक ही स्थान पर वर्ग 8 में रखा गया है। (iv) मेण्डेलीफ के समय उत्कृष्ट गैसों की खोज ही नहीं हुई थी। (v) तत्वों के समस्थानिकों को उचित स्थान नहीं मिला है। (vi) रासायनिक रूप से असमान तत्वों को एक साथ रखे गए हैं। (vii) कुछ स्थानों पर उन तत्वों को जिनका परमाणु द्रव्यमान उच्च है, उन तत्वों से पहले रखा गया है जिन तत्वों का परमाणु द्रव्यमान निम्न है। | (i) तत्वों को बढ़ते परमाणु क्रमांक में व्यवस्थित किया गया है। (ii) इस आवर्त सारणी 18 ऊर्ध्वाधर स्तंभ है जो कि वर्ग कहलाते हैं। (iii) वर्ग 3 से वर्ग 12 में संक्रमण तत्व रखे गए हैं। (iv) आधुनिक आवर्त सारणी में उत्कृष्ट गैसों का वर्ग 18 में व्यवस्थित किया गया है। (v) तत्वों के समस्थानिकों को उनके संगत तत्वों के स्थान पर ही रखा गया है क्योंकि उनके परमाणु क्रमांक समान होते हैं। (vi) रासायनिक रूप से असमान तत्वों को पृथक-पृथक वर्गो में रखा गया है। (vii) इसमें वर्गीकरण का आधार परमाणु क्रमांक है। इस प्रकार मैण्डेलीफ में वर्णित प्रतिलोम क्रम सम्बन्धी दोष को दूर कर दिया है। |
You must watch ….
Bihar Board Class 10 Science Chemistry Solution
- Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण
- Chapter 2 अम्ल, क्षारक एवं लवण
- Chapter 3 धातु एवं अधातु
- Chapter 4 कार्बन एवं इसके यौगिक
Bihar Board Class 10 Science Biology Solution
- Chapter 1 जैव प्रक्रम
- Chapter 2 नियंत्रण एवं समन्वय
- Chapter 3 जीव जनन कैसे करते है
- Chapter 4 अनुवांशिकता एवं जैव विकास
- Chapter 5 उर्जा के स्रोत
- Chapter 6 हमारा पर्यावरण
- Chapter 7 प्राकृतिक संसाधनों का प्रबंधन
