तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
अभ्यास के प्रश्न एवं उनके उत्तर
प्रश्न 3.1
आवर्त सारणी में व्यवस्था का भौतिक आधार क्या है?
उत्तर:
आवर्त सारणी में व्यवस्था का भौतिक आधार समान गुणधर्म वाले तत्त्वों को एक साथ एक ही वर्ग में रखना है। किसी वर्ग के तत्वों के परमाणुओं के संयोगी कोश विन्यास समान होते हैं। क्योंकि तत्त्वों के गुणधर्म उनके संयोजी कोश इलेक्ट्रॉनिक विन्यास पर निर्भर होते हैं।
प्रश्न 3.2
मेण्डेलीफ ने किस महत्त्वपूर्ण गुणधर्म को अपनी आवर्त सारणी में तत्वों के वर्गीकरण का आधार बनाया? क्या वे उस पर दृढ़ रह पाए?
उत्तर:
मेण्डेलीफ ने तत्वों के वर्गीकरण के लिए उनके परमाणु भारों को आधार बनाया। मेण्डेलीफ के आवर्त नियम के अनुसार, “तत्वों के गुणधर्म (भौतिक एवं रासायनिक गुण) उनके परमाणु भारों के आवर्ती फलन होते हैं।” परन्तु मेण्डेलीफ के वर्गीकरण का यह आधार दोषपूर्ण पाया गया; अत: मेण्डेलीफ इस आधार पर दृढ़ नहीं रह पाए।
प्रश्न 3.3
मेण्डलीफ के आवर्त नियम और आधुनिक आवर्त नियम में मौलिक अन्तर क्या है?
उत्तर:
मेण्डलीफ के आवर्त नियम के अनुसार तत्त्वों पर परमाणु भार आवर्तिता का आधार है जबकि आधुनिक आवर्त नियम के अनुसार तत्त्वों का परमाणु क्रमांक आवर्तिता का मुख्य आधार है।
प्रश्न 3.4
क्वांटम संख्याओं के आधार पर यह सिद्ध कीजिए कि आवर्त सारणी के छठवें आवर्त में 32 तत्त्व होने चाहिएँ।
उत्तर:
आवर्त सारणी छठवें आवर्त छठवें कोश के अनुरूप होता है जिसमें उपस्थित कक्षक 6s, 4f, 5p तथा 6d होते हैं। इलेक्ट्रॉनों की अधिकतम संख्या जो इन उपकोशों में हो सकती है –
निम्नवत् होगी –
2 + 14 + 6 + 10 = 32
चूँकि किसी आवर्त में तत्त्वों की संख्या कोशों में उपस्थित इलेक्ट्रॉनों की संख्या के अनुरूप होती है, अतः छठवें आवर्त में अधिकतम 32 तत्त्व को सकते हैं।
प्रश्न 3.5
आवर्त और वर्ग के पदों में यह बताइए कि Z = 14 कहाँ स्थित होगा?
उत्तर:
Z = 14 वाला तत्त्व तीसरे आवर्त और 14वें वर्ग में स्थित होगा।
प्रश्न 3.6
उस तत्त्व का परमाणु क्रमांक लिखिए, जो आवर्त सारणी में तीसरे आवर्त और 17 वें वर्ग में स्थित होता है।
उत्तर:
इस तत्त्व का परमाणु क्रमांक (Z)17 है।
प्रश्न 3.7
कौन-से तत्त्व का नाम निम्नलिखित द्वारा दिया गया है –
- लॉरेन्स बर्कले प्रयोगशाला द्वारा
- सीबोर्ग समूह द्वारा।
उत्तर:
- लॉरेन्शियम (Lr) जिसका परमाणु क्रमांक 103
- सीबर्गियम (Sg) जिसका परमाणु क्रमांक 106 है।
प्रश्न 3.8
एकही वर्ग में उपस्थित तत्त्वों के भौतिक और रासायनिक गुण धर्म समान क्यों होते हैं?
उत्तर:
किसी वर्ग में तत्त्वों के समान इलेक्ट्रॉनिक विन्यास होते हैं और परमाणवीय आकारों में भिन्नता होती है जो बढ़ने के लिए प्रवृत्त होते हैं। अत: एक ही वर्ग में उपस्थित तत्त्वों के भौतिक तथा रासायनिक गुण समान होते हैं।
प्रश्न 3.9
‘परमाणु त्रिज्या’ और ‘आयनिक त्रिज्या’ से आप क्या समझते हैं?
उत्तर:
परमाणु त्रिज्या-सह-संयोजक अणुओं में किसी तत्त्व के दो परमाणुओं के नाभिकों के बीच की दूरी के आधे भाग को परमाणु त्रिज्या या परमाणु आकार कहते हैं।

परमाणु त्रिज्या को A से प्रदर्शित किया जाता है।
आयनिक त्रिज्या:
किसी आयन के नाभिक और उस बिन्दु तक की दूरी जहाँ तक नाभिक इलेक्ट्रॉन मेघ को आकर्षित करता है, आयनिक त्रिज्या कहलाती है।
प्रश्न 3.10
किसी वर्ग या आवर्त में परमाणु त्रिज्या किस प्रकार परिवर्तित होती है? इस परिवर्तन की व्याख्या आप किस प्रकार करेंगे?
उत्तर:
आवर्त में परमाणु त्रिज्या बायें ओर से दायें ओर घटती है क्योंकि इलेक्ट्रॉन समान कोश में इलेक्ट्रॉन भरे जाते हैं और कोई नया कोश नहीं बनता है। किसी वर्ग में परमाणु त्रिज्या ऊपर से नीचे की ओर बढ़ती है जोकि इलेक्ट्रॉनों की कोश संख्या में वृद्धि तथा आवरणी प्रभाव के वृद्धि के कारण होता है।
प्रश्न 3.11
समइलेक्ट्रॉनिक स्पीशीज से आप क्या समझते हैं? एक ऐसी स्पीशीज का नाम लिखिए, जो निम्नलिखित परमाणुओं या आयनों के साथ समइलेक्ट्रॉनिक होगी –
- F¯
- Ar
- Mg2+
- Rb+
उत्तर:
समइलेक्ट्रॉनिक स्पीशीज-ऐसी स्पीशीज जिनमें इलेक्ट्रॉनों की संख्या समान हो, समइलेक्ट्रॉनिक स्पीशीज कहलाती है। दी गई स्पीशीज के संगत समइलेक्ट्रॉनिक स्पीशीज निम्नवत् है –
- Na+
- Ar
- Na+
- Sr2+
प्रश्न 3.12
निम्नलिखित स्पीशीज पर विचार कीजिए –
N3-, O2-, F–, Na+, Mg2+, Al3+
(क) इनमें क्या समानता है?
(ख) इन्हें आयनिक त्रिज्या के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर:
(क) इन सभी की समइलेक्ट्रॉनिक प्रकृति है और इनमें से प्रत्येक का परमाणु क्रमांक 10 है।
(ख) आयनिक त्रिज्याओं का बढ़ता क्रम निम्नवत् है –
Al3+< Mg2+< NO+< F–< O2-< N3-
प्रश्न 3.13.
धनायन अपने जनक परमाणुओं से छोटे क्यों होते हैं और ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक क्यों होती है? व्याख्या कीजिए।
उत्तर:
धनायन अपने जनक परमाणु से छोटा होता है क्योंकि जब परमाणु से इलेक्ट्रॉन त्याग दिये जाते हैं तो धनायन बनते हैं। जब यह समान नाभिकीय आवेश शेष इलेक्ट्रॉनों पर कार्य करता है जिससे प्रभावी नाभिकीय आवेश में वृद्धि हो जाती है, जिससे धनायन के आकार में कमी आ जाती है। ऋणायन में अपने जनक परमाणु से अधिक इलेक्ट्रॉन होते हैं, जिससे इलेक्ट्रॉनों के मध्य प्रतिकर्षण बढ़ जाता है और प्रभावी नाभिकीय आवेश में कमी आ जाती है। इसके अतिरिक्त इलेक्ट्रॉन-मेघ नाभिक द्वारा बंधा होता है अतः इनकी त्रिज्यायें जनक परमाणुओं से अधिक होती हैं।
प्रश्न 3.14.
आयनन एन्थैल्पी और इलेक्ट्रॉन लब्धि एन्थैल्पी को परिभाषित करने में विलगित गैसीय परमाणु तथा ‘आद्य अवस्था’ पदों की सार्थकता क्या है?
उत्तर:
1. विलगित गैसीय परमाणु की सार्थकता-जब कोई परमाणु गैसीय अवस्था में विलगित होता है तो इसकी इलेक्ट्रॉन त्यागने और इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति असीमित होती है। अतः इनकी आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी के मान अन्य परमाणुओं की उपस्थिति में प्रभावित नहीं होते हैं। जब परमाणु द्रव या ठोस या द्रव अवस्था में हो तो इन्हें व्यक्त करना असम्भव है।
2. आद्य अवस्था की सार्थकता-इससे यह तात्पर्य है कि जब कोई विशेष परमाणु और इससे सम्बन्धित इलेक्ट्रॉन न्यूनतम ऊर्जा अवस्था में होते हैं तो इससे परमाणु की सामान्य ऊर्जा प्रदर्शित होती है। आयनन एन्थैलपी और इलेक्ट्रॉन ग्रहण एथैल्पी दोनों को प्रायः परमाणु की आद्य अथवा उत्तेजित अवस्थाओं के सापेक्ष व्यक्त किया जाता है?
प्रश्न 3.15
हाइड्रोजन परमाणु में आद्य अवस्था में इलेक्ट्रॉन की ऊर्जा -2.18 × 10-18 J है। परमाणविक हाइड्रोजन की आयनन एंथैल्पी J mol-1 के पदों में परिकलित कीजिए।
[संकेत-उत्तर प्राप्त करने के लिये मोल संकल्पना का उपयोग कीजिए।]
उत्तर:
∵ आयनन एंथैल्पी 1 मोल परमाणुओं के लिए है।
∴ 1 मोल परमाणुओं की आद्य अवस्था ऊर्जा
= Eआद्य अवस्था
= -2.18 × 10-18 J × 6.022 × 1023
= -1.312 × 106 J
अत: आयनन एंथैल्पी = Eα – Eआद्य अवस्था
= -(-1.312 × 106 J)
= 1.312 × 106 J
प्रश्न 3.16
द्वितीय आवर्त के तत्वों में वास्तविक आयनन एन्थैली का क्रम इस प्रकार है –
1. Li < B < Be < C < O < N < F < Ne
व्याख्या कीजिए कि (i) Be की ∆i, H, B से अधिक क्यों –
2. 0 की A,H,N और F से कम क्यों है?
उत्तर:
1. Be तथा B के इलेक्ट्रॉनिक विन्यास निम्नांकित प्रकार हैं –
4Be = 2, 2 या 1s2, 2s2
5B = 2, 3 या 1s2, 2s2 2p1
बोरॉन (B) में, इसके एक 2p कक्षक में एक अयुग्मित इलेक्ट्रॉन है। बेरिलियम (Be) में युग्मित इलेक्ट्रॉनों वाले पूर्ण-पूरित 1s तथा 2s कक्षक हैं। जब हम एक ही मुख्य क्वाण्टम ऊर्जा स्तर पर विचार करते हैं तो s – इलेक्ट्रॉन p – इलेक्ट्रॉन की तुलना में नाभिक की ओर अधिक आकर्षित होता है। बेरिलियम में बाह्यतम इलेक्ट्रॉन, जो अलग किया जाएगा, वह s – इलेक्ट्रॉन होगा, जबकि बोरॉन में बाह्यतम इलेक्ट्रॉन (जो अलग किया जाएगा) p – इलेक्ट्रॉन होगा।
उल्लेखनीय है कि नाभिक की ओर 2s – इलेक्ट्रॉन का भेदन (penetration) 2p – इलेक्ट्रॉन की तुलना में अधिक होता है। इस प्रकार बोरॉन का 2p – इलेक्ट्रॉन बेरिलियम के 2s – इलेक्ट्रॉन की तुलना में आन्तरिक क्रोड इलेक्ट्रॉनों द्वारा अधिक परिक्षित होता है। चूँकि बेरिलियम के 2s – इलेक्ट्रॉन की तुलना में बोरॉन का 2p-इलेक्ट्रॉन अधिक सरलता से पृथक् हो जाता है; अत: बेरिलियम की तुलना में बोरॉन की प्रथम आयनन एन्थैल्पी (∆i, H) का मान कम होगा।

स्पष्ट है कि नाइट्रोजन में तीनों बाह्यतम 2p – इलेक्ट्रॉन विभिन्न p – कक्षकों में वितरित हैं (हुण्ड का नियम), जबकि ऑक्सीजन के चारों 2p – इलेक्ट्रॉनों में से दो 2p – इलेक्ट्रॉन एक ही 2p – ऑर्बिटल में हैं; फलतः इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है। फलस्वरूप नाइट्रोजन के तीनों 2p – इलेक्ट्रॉनों में से एक इलेक्ट्रॉन पृथक् करने की तुलना में ऑक्सीजन के चारों 2p – इलेक्ट्रॉनों में से चौथे इलेक्ट्रॉन को पृथक् करना सरल हो जाता है; अतः O की प्रथम आयनन एन्थैली (∆i, H) का मान N से कम होता है। यही स्पष्टीकरण F के लिए भी दिया जा सकता है।
प्रश्न 3.17
आप इस तथ्य की व्याख्या किस प्रकार करेंगे कि सोडियम की प्रथम आयनन एन्यैल्पी मैग्नीशियमम की प्रथमं आयनन एन्थैल्पी से कम है, किन्तु इसकी द्वितीय आयनन एन्थैल्पी मैग्नीशियम की द्वितीय आयनन एन्थैल्पी से अधिक है?
उत्तर:
सोडियम (Na) तथा मैग्नीशियम (Mg) के इलेक्ट्रॉनिक विन्यास निम्न प्रकार हैं –
11Na = 2, 8, 1 या 1s2, 2s2, 2p6, 3s1
12Mg = 2, 8, 2 या 1s2, 2s2, 2p6, 3s2
उपर्युक्त इलेक्ट्रॉनिक विन्यासों से स्पष्ट है कि Mg का इलेक्ट्रॉनिक विन्यास पूर्ण-पूरित 3s कक्षक की उपस्थिति के कारण स्थायी है जिससे इलेक्ट्रॉन निकालना, Na के 3s कक्षक से इलेक्ट्रॉन निकालने की तुलना में, कठिन है; अतः सोडियम की प्रथम आयनन एन्थैल्पी मैग्नीशियम की प्रथम आयनन एन्थैल्पी से कम है। परन्तु सोडियम की द्वितीय आयनन एन्थैलपी मैग्नीशियम की द्वितीय आयनन एन्थैल्पी से अधिक होती है।
इसका कारण यह है कि सोडियम से एक 3s – कक्षक इलेक्ट्रॉन निकलने के पश्चात् यह एक अस्थायी विन्यास 1s2, 2s2, 2p6, प्राप्त कर लेता है, जबकि मैग्नीशियम से इलेक्ट्रॉन निकलने के पश्चात् यह एक अस्थायी विन्यास 1s2, 2s2, 2p6, 3s1, प्राप्त करता है। फलतः मैग्नीशियम से 3s – कक्षक इलेक्ट्रॉन निकालना, सोडियम से इलेक्ट्रॉन निकालने की तुलना में सरल हो जाता है। परिणामस्वरूप सोडियम की द्वितीय आयनन एन्थैल्पी मैग्नीशियम की द्वितीय आयनन एन्थैल्पी से अधिक होती है।
प्रश्न 3.18
मुख्य समूह तत्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के कौन-से कारक हैं?
उत्तर:
मुख्य समूह तत्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के विभिन्न कारक निम्नलिखित है –
- समूह में नीचे जाने पर नाभिकीय आवेश बढ़ता है।
- समूह में नीचे जाने पर प्रत्येक तत्व में नए कोश जुड़ जाने के कारण परमाणु आकार बढ़ जाते हैं।
- समूह में नीचे जाने पर आन्तरिक इलेक्ट्रॉनों की संख्या बढ़ जाती है। इससे बाह्यतम इलेक्ट्रॉनों पर आवरण-प्रभाव घट जाता है।
परमाणु आकार में वृद्धि तथा आवरण-प्रभाव का संयुक्त प्रभाव नाभिकीय आवेश में वृद्धि के प्रभाव से अधिक हो जाता है। ये प्रभाव इस प्रकार कार्य करते हैं कि नाभिक तथा बाह्यतम इलेक्ट्रॉनों के मध्य आकर्षण बल कम हो जाता है। परिणामस्वरूप समूह में नीचे जाने पर आयनन एन्थैल्पी कम हो जाती है।
प्रश्न 3.19
वर्ग 13 के तत्वों की प्रथम आयनन एन्थैल्पी के मान (kJ mol-1) में इस प्रकार हैं –

सामान्य से इस विचलन की प्रवृत्ति की व्याख्या आप किस प्रकार करेंगे?
उत्तर:
B से A1 तक प्रथम आयनन एन्थैलपी (∆iH1) के मान कम होना A1 परमाणु के बड़े आकार के कारण स्वाभाविक है, परन्तु तत्व Ga में दस 3d – इलेक्ट्रॉन इसके 3d – उपकोश में उपस्थित हैं जो ऽ – तथा p – इलेक्ट्रॉनों के समान आवरित नहीं होते; अतः प्रभावी नाभिकीय आवेश में होने वाली अस्वाभाविक वृद्धि के परिणामः प्रथम आयनन एन्थैलपी का मान बढ़ जाता है।
यही स्पष्टीकरण 1n से T1 तक किया जा सकता है। T1 में अत्यन्त क्षीण आवरण प्रभाव के साथ चौदह 4f इलेक्ट्रॉन हैं। इसके परिणामस्वरूप भी प्रभावी नाभिकीय आवेश में अस्वाभाविक वृद्धि प्रथम आयनन एन्थैल्पी के मान को बढ़ा देती है।
प्रश्न 3.20
तत्वों के निम्नलिखित युग्मों में किस तत्व की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी?
- O या F
- F या Cl
उत्तर:
1. F की इलेक्ट्रॉन लब्धि एन्थैलपी अधिक ऋणात्मक होगी। तत्व, जब इलेक्ट्रॉन ग्रहण करते हैं, तब ऊर्जा निर्मुक्त होती है। ऐसी अवस्था में इलेक्ट्रॉन लब्धि एन्थैल्पी ऋणात्मक होगी। F तत्व (या 17 वें वर्ग के सभी हैलोजेन तत्व) की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान अधिक ऋणात्मक (-328kJ mol-1) होने का कारण यह है कि मात्र एक इलेक्ट्रॉन ग्रहण करके यह स्थायी उत्कृष्ट गैस का इलेक्ट्रॉनिक विन्यास प्राप्त कर लेता है, जबकि ऑक्सीजन (1s2, 2s2, 2p4) में ऐसा नहीं है (∆eg H = -141kJ mol-1); अत: F की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होती है।
2. C1 की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी। चूँकि फ्लुओरीन परमाणु आकार में छोटा होता है; अतः F परमाणु का इलेक्ट्रॉन – आवेश घनत्व उच्च होता है तथा जुड़ने वाले इलेक्ट्रॉन प्रबल इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण अनुभव करते हैं। परिणामस्वरूप, जब F परमाणु से एक इलेक्ट्रॉन जुड़ता है तो ऊर्जा की एक निश्चित मात्रा अवशोषित होती है तथा ऋणायन के बनने के दौरान निर्मुक्त कुल ऊर्जा में कमी आ जाती है।
यदि इलेक्ट्रॉन को अपेक्षाकृत बड़े p – कक्षक (C1 की स्थिति में 3p-कक्षक) से जोड़ा जाता है तो इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण अत्यन्त कम हो जाता है तथा इलेक्ट्रॉन लब्धि एन्थैल्पी का उच्च मान प्रेक्षित होता है; अतः फ्लुओरीन की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान क्लोरीन की अपेक्षा कम होता है।
प्रश्न 3.21
आप क्या सोचते हैं कि O की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी प्रथम इलेक्ट्रॉन लब्धि एन्थैल्पी के समान धनात्मक, अधिक ऋणात्मक या कम ऋणात्मक होगी? अपने उत्तर की पुष्टि कीजिए।
उत्तर:
ऑक्सीजन की द्वितीय इलेक्ट्रॉन लब्धि एन्थैलपी धनात्मक होगी (∆egH = 780kJmol-1) ऑक्सीजन परमाणु का आकार छोटा होता है तथा इसका नाभिकीय आवेश उच्च होता है। उच्च आवेश-घनत्व के कारण यह सरलता से इलेक्ट्रॉन ग्रहण कर लेता है तथा ऊर्जा निर्मुक्त होती है। इस प्रकार प्राप्त O–(g) समान आवेशों के मध्य स्थिर-विद्युत प्रतिकर्षण के कारण सरलता से इलेक्ट्रॉन ग्रहण नहीं करता; अत: द्वितीय इलेक्ट्रॉन-इलेक्ट्रॉन को O–(g) में प्रवेश कराने हेतु कुछ ऊर्जा की आवश्यकता पड़ती है।
प्रतिकर्षण समाप्त करने के लिए आवश्यकता यह ऊर्जा, इलेक्ट्रॉन ग्रहण करने में निर्मुक्त ऊर्जा से अधिक हो जाती है। फलतः कुल ऊर्जा अवशोषित होती है। उपर्युक्त व्याख्या से यह स्पष्ट होता है कि ऑक्सीजन की प्रथम इलेक्ट्रॉन लब्धि एन्थैल्पी ऋणात्मक तथा द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी धनात्मक होती है।
प्रश्न 3.22
इलेक्ट्रॉन लब्धि एन्थैल्पी और इलेक्ट्रॉन ऋणात्मकता में क्या मूल अन्तर हैं?
उत्तर:
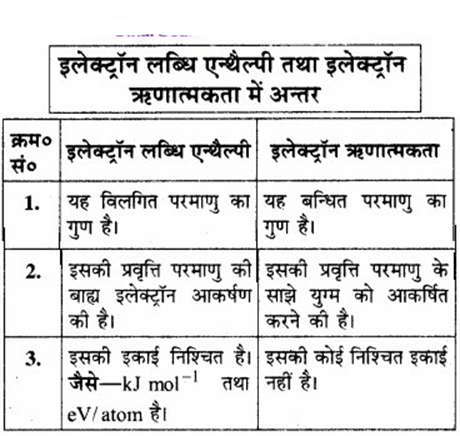
प्रश्न 3.23
सभी नाइट्रोजन यौगिकों में N की विद्युत ऋणात्मकता पॉलिंग पैमाने पर 3.0 है। आप इस कथन पर अपनी क्या प्रतिक्रिया देंगे?
उत्तर:
पॉलिंग पैमाने पर नाइट्रोजन की विद्युत ऋणात्मकता 3.0 है जिससे यह स्पष्ट होता है कि यह पूर्णतया विद्युत ऋणात्मक अतः इसके छोटे आकार और उत्कृष्ट गैस का इलेक्ट्रॉनिक विन्यास प्राप्त करने के लिए 3 इलेक्ट्रॉनों की आवश्यकता होती है। यह सभी यौगिकों में नाइट्रोजन की विद्युत ऋणात्मकता 3 होती है मान्य नहीं है। यह किसी विशेष यौगिक में इसकी संकरण अवस्था पर निर्भर है। s – लक्षण जितना अधिक होगा, उतना ही तत्त्व की विद्युत ऋणात्मकता अधिक होगी।
प्रश्न 3.24
उस सिद्धान्त का वर्णन कीजिए, जो परमाणु की त्रिज्या से सम्बन्धित होता है –
- जब वह इलेक्ट्रॉन प्राप्त करता है।
- जब वह इलेक्ट्रॉन का त्याग करता है।
उत्तर:
1. जब परमाणु एक या अधिक इलेक्ट्रॉन प्राप्त करता है, तब ऋणायन बनता है। परमाणु के ऋणायन में परिवर्तन के दौरान एक या अधिक इलेक्ट्रॉन परमाणु के संयोजी कोश से जुड़ जाते हैं। नाभिकीय आवेश परमाणु के समान ही रहता है। संयोजी कोश में इलेक्ट्रॉनों की संख्या में वृद्धि, इलेक्ट्रॉनों द्वारा परस्परीय परिरक्षण की अधिकता के कारण, प्रभावी नाभिकीय आवेश को कम कर देती है। परिणामस्वरूप इलेक्ट्रॉन-मेघ विस्तृत हो जाता है अर्थात् आयनिक त्रिज्या बढ़ जाती है।
2. जब परमाणु एक या अधिक इलेक्ट्रॉनों का त्याग करता है, तब धनायन बनता है। इस प्रकार प्राप्त धनायन सदैव अपने जनक परमाणु से आकार में छोटा होता है। ऐसा निम्नलिखित कारणों से हो सकता है –
(a) संयोजी कोश के विलोपन द्वारा (By elimination of valence shell):
कुछ स्थितियों में, इलेक्ट्रॉन त्यागने पर संयोजी कोश का पूर्णतया विलोपन हो जाता है। बाह्यतम कोश विलुप्त होने के कारण धनायन के आकार में कमी आ जाती है।
(b) प्रभावी नाभिकीय आवेश में वृद्धि के द्वारा (By increase in effective nuclear charge):
धनायन में, इलेक्ट्रॉनों की संख्या जनक परमाणु से कम होती है। कुल नाभिकीय आवेश समान रहता है। यह प्रभावी नाभिकीय आवेश को बढ़ा देता है। परिणामस्वरूप, इलेक्ट्रॉन नाभिक से अधिक दृढ़ता से जुड़े रहते हैं जिससे इनके आकार में कमी आ जाती है।
प्रश्न 3.25
किसी तत्त्व के दो समस्थानिकों की प्रथम आयनन एन्थैल्पी समान होगी या भिन्न? आप क्या मानते हैं? अपने उत्तर की पुष्टि कीजिए।
उत्तर:
चूँकि तत्त्व की आयनन एन्थैल्पी, इसके नाभिकीय आवेश के परिमाण तथा इलेक्ट्रॉनिक विन्यास से सम्बन्धित है और तत्त्व के समस्थानिकों का नाभिकीय आवेश व इलेक्ट्रॉनिक विन्यास समान होता है। अतः इन दो समस्थानिकों की प्रथम आयनन एन्थैल्पी भी समान होगी।
प्रश्न 3.26
धातुओं तथा अधातुओं में मुख्य अन्तर क्या है।
उत्तर:
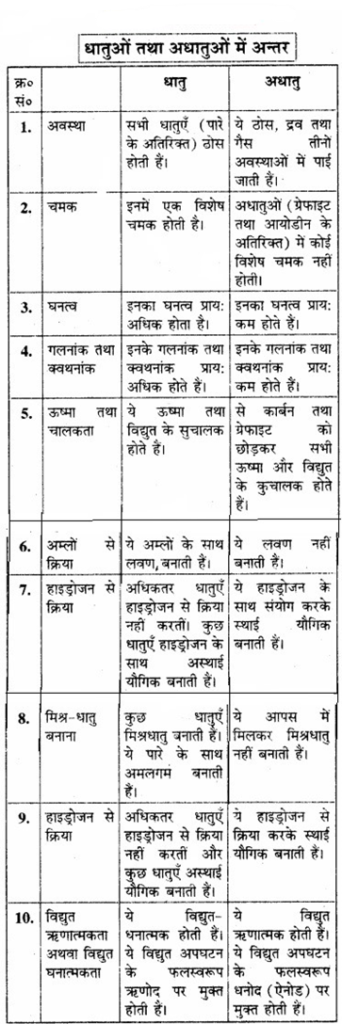
प्रश्न 3.27
आवर्त सारणी का उपयोग करते हुए निम्नलिखित प्रश्नों के उत्तर दीजिए –
(क) उस तत्त्व का नाम बताइए, जिसके बाह्य उप-कोश में पाँच इलेक्ट्रॉन उपस्थित हों।
(ख) उस तत्त्व का नाम बताइए, जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को त्यागने की हो।
(ग) उस तत्त्व का नाम बताइए, जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को प्राप्त करने की हो।
(घ) उस वर्ग का नाम बताइए, जिसमें सामान्य ताप पर धातु, अधातु, द्रव और गैस उपस्थित हों।
उत्तर:
(क) ये तत्त्व नाइट्रोजन परिवार (वर्ग 15) N, P, As, Sb, Bi से सम्बन्धित हैं। इन तत्त्वों के बाह्य कोश में पाँच इलेक्ट्रॉन होते हैं।
(ख) ये तत्त्व समूह 2 तथा क्षारीय मृदा परिवार से सम्बन्धित हैं। इस परिवार में Be, Mg, Ca, Sr, Ba तत्त्व सम्मिलित हैं। इन तत्त्वों की प्रवृत्ति दो इलेक्ट्रॉन त्यागने की है।
(ग) ये तत्त्व ऑक्सीजन परिवार से सम्बन्धित हैं और इस परिवार में O, S, Se, Te तत्त्व सम्मिलित हैं। इन तत्त्वों की प्रवृत्ति 2 इलेक्ट्रॉन त्यागने की है।
(घ) वर्ग 13 है।
प्रश्न 3.28
प्रथम वर्ग के तत्त्वों के लिए अभिक्रियाशीलता का बढ़ता हुआ क्रम इस प्रकार है –
Li < Na < K < Rb < Cs; जबकि वर्ग 17 के तत्त्वों में क्रम F > CI > Br > 1 है। इसकी व्याख्या कीजिए।
उत्तर:
प्रथम वर्ग के तत्त्वों की अभिक्रियाशीलता इनके परमाणुओं के इलेक्ट्रॉनों के त्यागने के कारण है जो कि आयतन एन्थैल्पी से सम्बन्धित है। चूँकि आयनन एन्थैल्पी वर्ग में ऊपर से नीचे जाने पर घटती है, अतः धातुओं की अभिक्रियाशीलता बढ़ती वर्ग 17 (हैलोजेनों) की अभिक्रियाशीलता इलेक्ट्रॉनों के ग्रहण करने की प्रवृत्ति से सम्बन्धित है। चूंकि ये दोनों वर्ग में नीचे जाने पर घटते हैं, अत: अभिक्रियाशीलता भी घटती है।
प्रश्न 3.29
-s-, p-, d – और f – ब्लॉक के तत्त्वों का सामान्य बाह्य इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
s – ब्लॉक के तत्त्वों का इलेक्ट्रॉनिक विन्यास ns1-2 होता है।
p – ब्लॉक के तत्त्वों का इलेक्ट्रॉनिक विन्यास ns2 np1-6 होता है। ब्लॉक के तत्त्वों का इलेक्ट्रॉनिक विन्यास (n-1)d1-10 ns1-2 होता है।
f – ब्लॉक के तत्त्वों का इलेक्ट्रॉनिक विन्यास (n-2) f1-14 (n-1)d1 ns2 होता है।
प्रश्न 3.30
तत्त्व, जिसका बाह्य इलेक्ट्रॉनिक विन्यास निम्नलिखित हैं, का स्थान आवर्त सारणी में बताइए –
- ns2 np4, जिसके लिए n = 3 है।
- (n-1)d2 ns2, जब n = 4 है तथा
- (n-2) f7 (n-1)d1 ns2, जब n = 6 है।
उत्तर:
- यह तत्त्व तीसरे आवर्त में तथा वर्ग 16 में स्थित है।
- यह तत्त्व चौथे आवर्त तथा वर्ग 4 में स्थित है।
- यह तत्त्व छठे आवर्त और वर्ग 3 में स्थित है।
प्रश्न 3.31
कुछ तत्वों की प्रथम ∆iH1 और द्वितीय ∆iH2 आयनन एन्थैल्पी (kJ mol-1 में) और इलेक्ट्रॉन लब्धि एन्थैल्पी (∆eg H) (kJ mol-1 में) निम्नलिखित है –
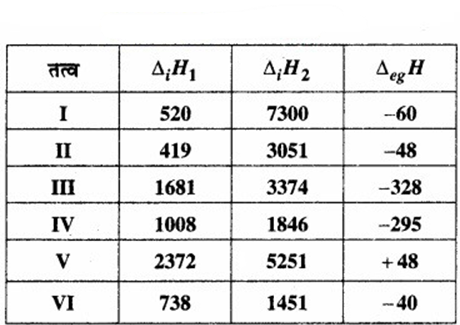
ऊपर दिए गए तत्वों में से कौन – सी –
(क) सबसे कम अभिक्रियाशील धातु है?
(ख) सबसे अधिक अभिक्रियाशील धातु है?
(ग) सबसे अधिक अभिक्रियाशील अधातु है?
(घ) सबसे कम अभिक्रियाशील अधातु है?
(ङ) ऐसी धातु है, जो स्थायी द्विअंगी हैलाइड (binary halide), जिनका सूत्र MX2 (X = हैलोजेन ) है, बनाता है।
(च) ऐसी धातु, जो मुख्यतः MX (X = हैलोजेन) वाले स्थायी सहसंयोजी हैलाइड बनाती है।
उत्तर:
(क) तत्व V की आयनन एन्थैलपी उच्चतम है; अत: यह सबसे कम अभिक्रियाशील धातु है।
(ख) न्यूनतम प्रथम आयनन एन्थैल्पी वाले तत्व सरलता से इलेक्ट्रॉन त्याग देते हैं, इसलिए ये अधिक अभिक्रियाशील होते हैं। तत्व II की प्रथम आयनन एन्थैल्पी न्यूनतम है; अत: यह सबसे अधिक अभिक्रियाशील धातु है।
(ग) अधातुओं की आयनन एन्थैल्पी उच्च होती हैं (उत्कृष्ट गैसों से कम)। अत: तत्व III सबसे अधिक अभिक्रियाशील अधातु है।
(घ) तत्व IV सबसे कम अभिक्रियाशील अधातु हैं।
(ङ) धातुओं की आयनन सबसे एन्थैल्पी अपेक्षाकृत कम होती हैं। वर्ग 2 के तत्वों की प्रथम आयनन एन्थैल्पी वर्ग 1 के तत्वों की तुलना में उच्च होती हैं। चूँकि तत्व M, सूत्र MX2, का एक स्थायी द्विअंगी हैलाइड बनाता है; अत: M को आवर्त सारणी के वर्ग 2 से सम्बन्धित होना चाहिए। वर्ग 2 के तत्वों के लिए प्रथम एवं द्वितीय आयनन एन्थैल्पी का योग इनके समीपवर्ती तत्वों की तुलना में कम होता है। इससे स्पष्ट है कि तत्व VI ही वह धातु है जो सूत्र MX2 के द्विअंगी हैलाइड को बनाने की क्षमता रखती है।
(च) धातु, जो मुख्यत: MX (X = हैलोजेन) वाले स्थायी सहसंयोजक हैलाइड बनाती है, तत्व । है चूँकि वर्ग 1 में तत्वों के छोटे आकारों के कारण आयनन एन्थैल्पी उच्च होती है।
प्रश्न 3.32
तत्त्वों के निम्नलिखित युग्मों के संयोजन से बने स्थाई द्विअंगी यौगिकों के सूत्रों की प्रगुक्ति कीजिए –
(क) लीथियम और ऑक्सीजन
(ख) मैग्नीशियम और नाईट्रोजन
(ग) एल्यूमीनियम और आयोडीन
(घ) सिलिकॉन और ऑक्सीजन
(ङ) फॉस्फोरस और फ्लुओरीन
(च) 71 वाँ तत्त्व और फ्लु ओरीन
उत्तर:
(क) Li2O
(ख) Mg3N2
(ग) All3
(घ) SiO2
(ङ) PF6
(च) LuF2
प्रश्न 3.33
आधुनिक आवर्त सारणी में आवर्त निम्नलिखित में से किसको व्यक्त करता है?
(क) परमाणु संख्या
(ख) परमाणु द्रव्यमान
(ग) मुख्य क्वांटम संख्या
(घ) द्विगंशी क्वांटम संख्या
उत्तर:
(ग) मुख्य क्वांटम संख्या।
प्रश्न 3.34
आधुनिक आवर्त सारणी के लिए निम्नलिखित के संदर्भ में कौन-सा कथन सही नहीं है?
(क) p – ब्लॉक में 6 स्तम्भ हैं, क्योंकि p – कोश के सभी कक्षक भरने के लिए अधिकतम 6 इलेक्ट्रॉनों की आवश्यकता होती है।
(ख) d – ब्लॉक में 8 स्तम्भ हैं, क्योंकि d – उपकोश के कक्षक भरने के लिए अधिकतम 8 इलेक्ट्रॉनों की आवश्यकता होती है।
(ग) प्रत्येक ब्लॉक में स्तम्भों की संख्या उस उपकोश में भरे जा सकने वाले इलेक्ट्रॉनों की संख्या के बराबर होती है।
(घ) तत्त्व के इलेक्ट्रॉन विन्यास को भरते समय अन्तिम भरे जाने वाले इलेक्ट्रॉन का उपकोश उसके द्विगंशी क्वांटम संख्या को प्रदर्शित करता है।
उत्तर:
(ख) यह कथन सही नहीं है क्योंकि d – ब्लॉक में 10 स्तम्भ हैं और d – ब्लॉक के कक्षक भरने के लिए अधिकतम 10 इलेक्ट्रॉनों की आवश्यकता होती है।
प्रश्न 3.35
ऐसा कारक, जो संयोजकता इलेक्ट्रॉन को प्रभावित करता है, उस तत्त्व की रासायनिक प्रवृत्ति भी प्रभावित करता है। निम्नलिखित में से कौन-सा कारक संयोजकता कोश को प्रभावित नहीं करता?
(क) संयोजक मुख्य क्वांटम संख्या (n)
(ख) नाभिकीय आवेश (Z)
(ग) नाभिकीय द्रव्यमान
(घ) क्रोड इलेक्ट्रॉनों की संख्या
उत्तर:
(ग) नाभिकीय द्रव्यमान
प्रश्न 3.36
समइलेक्ट्रॉनिक स्पीशीज F–, Ne और Na+ का आकार इनमें से किससे प्रभावित होता है?
(क) नाभिकीय आवेश (Z)
(ख) मुख्य क्वांटम संख्या (n)
(ग) बाह्य कक्षकों में इलेक्ट्रॉन-इलेक्ट्रॉन अन्योन्य क्रिया
(घ) ऊपर दिये गये कारणों में से कोई भी नहीं, क्योंकि उनका आकार समान है।
उत्तर:
(क) नाभिकीय आवेश (Z)।
प्रश्न 3.37
आयनन एंथैल्पी के संदर्भ में निम्नलिखित में से कौन-सा कथन असत्य गलत है?
(क) प्रत्येक उत्तरोत्तर इलेक्ट्रॉन से आयनन एंथैल्पी बढ़ती है।
(ख) क्रोड उत्कृष्ट गैस के विन्यास से जब इलेक्ट्रॉन को निकाला जाता है तब आयनन एंथेल्पी का मान अत्यधिक होता है। .
(ग) आयनन एंथैल्पी के मान में अत्यधिक तीव्र वृद्धि संयोजकता इलेक्ट्रॉनों के विलोपन को व्यक्त करता है।
(घ) कम n मान वाले कक्षकों में अधिक n मान वाले कक्षकों की तुलना में इलेक्ट्रॉनों को आसानी से निकाला जा सकता है।
उत्तर:
(घ) असत्य है।
प्रश्न 3.38
B, AI, Mg, K तत्त्वों के लिए धात्विक अभिलक्षण का सही क्रम इनमें कौन-सा है?
(क) b > Al > Mg > K
(ख) Al > Mg > B > K
(ग) Mg > AL > K > B
(घ) K > Mg > AI > B
उत्तर:
सही क्रम निम्नवत् है –
(घ) K > Mg > Al > B
प्रश्न 3.39
तत्त्वों B, C, N, F और Si के लिए अधातु अभिलक्षण का इनमें से सही क्रम कौन-सा है?
(क) B > C > Si > N > F
(ख) Si > C > B > N > F
(ग) F > N > C > B > Si
(घ) F > N > C > Si > B
उत्तर:
सही क्रम निम्नवत् है –
(ग) F > N > C > B > Si
प्रश्न 3.40
तत्त्वों F, CI, O और N तथा ऑक्सीकरण गुणधर्मों के आधार पर उनकी रासायनिक अभिक्रियाशीलता का क्रम निम्नलिखित में से कौन-से तत्त्वों में है?
(क) F > CI > O > N
(ख) F > O > CI > N
(ग) CI > F > O > N
(घ) O > F > N > CI
उत्तर:
सही क्रम निम्नवत् है –
(ख) F > O > Cl > N
